| |
 |
 |
 |
 |
| |
LES ALLOGREFFES DE CELLULES SOUCHES HEMATOPOIETIQUES
Une allogreffe de cellules souches hématopoïétiques peut se faire entre :
- deux jumeaux monozygotes : ou greffe syngénique
- deux frères ou soeurs de la même fratrie ou greffe génoidentique
- deux personnes non apparentées ou greffe phénoidentique
Une allogreffe peut être faite dès le diagnostic de la maladie sans traitement préalable lors de déficit immunitaire ou d'aplasie médullaire ou après une
chimiothérapie lors de leucémie aiguë ou de tumeurs solides. La greffe est envisagée lorsque la maladie est en rémission ou en très bonne réponse partielle.
Elle survient le plus souvent 3 à 6 mois après le diagnostic avant que des gènes de résistance à la chimiothérapie gênent le traitement de la maladie.
1. Le greffon :
Il ne peut être prélevé que si le donneur ne court aucun risque lors du prélèvement.
Différents types de greffons existent :
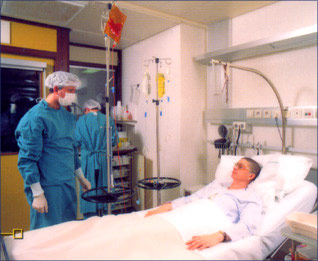
- médullaire :
|
c'est la technique de référence faite depuis plus de 20 ans. Elle nécessite une hospitalisation de 48 heures et une anesthésie
générale de 2 heures pendant laquelle la moelle est prélevée par ponctions, multiples au niveau du bassin et éventuellement du sternum (photo).
C'est la seule technique autorisée chez le donneur mineur.
|
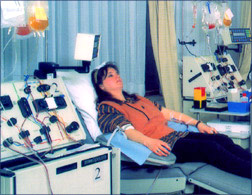 |
- cellules souches du sang circulant :
|
les cellules souches sont mobilisées de la moelle vers le sang périphérique grâce à un médicament
de la classe des facteurs de croissance : G-CSF. Il a une autorisation d'utilisation dans le prélèvement des cellules souches hématopoïétiques chez le
donneur sain. Il est utilisé en thérapeutique chez des patients depuis plus de dix ans à des doses plus élevées et sur des périodes de temps beaucoup
plus longues sans qu'aucun effet à long terme n'ait été retrouvé . Le prélèvement se fait sur une machine de tri cellulaire au moyen d'un dispositif à
usage unique stérile, les cellules sélectionnées sont les cellules dites mononucléées contenant les cellules souches provenant de la moelle. Les autres
cellules et notamment les globules rouges sont réinjectés au donneur.
|
 |
- cellules souches du sang de cordon :
|
prélevées à la naissance au niveau du cordon ombilical, les cellules du sang ombilical ont des capacités de
prolifération et d'expansion plus grandes que celles de l'adulte et sont par ailleurs plus immatures ce qui permet de réaliser des allogreffes avec
une compatibilité HLA non complète.
|
 |
2. le conditionnement :
La greffe survient après préparation du patient (le conditionnement).
Le conditionnement peut avoir, en fonction des situations, plusieurs buts : traiter directement les cellules de la maladie grâce à la chimiothérapie
et permettre la prise du greffon en traitant le système immunitaire du patient afin d'éviter le rejet.
- le conditionnement myélo-ablatif : il est réalisé par de fortes doses de chimiothérapie et par radiothérapie induisant une cytoréduction importante
des cellules tumorales et le contrôle antitumoral immunologique assuré par les cellules lymphocytaires T allogéniques appelé effet " Graft Versus Leukemia " (
GVL). La cytotoxicité de ce conditionnement participe de façon notable à la toxicité de la greffe allogénique par les complications de l'aplasie avec fièvre,
surinfection bactérienne et fungique.
- le conditionnement non myélo-ablatif : il est réalisé par l'utilisation combinée de produits extrêmement immunosuppresseurs avec une bonne qualité
de prise et une réduction notable de toxicité chez des populations à haut risque (âgés).
Les premiers essais faits d'abord chez l'animal, puis depuis 2 ans chez l'homme permettent d'élargir les indications des allogreffes aux tumeurs solides
et aux patients âgés.
3. la greffe :
Elle est réalisée en secteur protégé 24 à 48h après la fin du conditionnement une fois les drogues chimiothérapiques éliminées.
4. les complications
- la GVH : réaction du greffon contre l'hôte
Elle est liée à l'effet des cellules immunitaires (lymphocytes) contenues dans le greffon contre les organes normaux du patient (notamment la peau, le foie
et le tube digestif).
Bien qu'un traitement adapté puisse prévenir ou traiter ces complications, chacune d'elle présente un risque d'évolution défavorable.
Il existe deux types de GVH :
- la GVH aiguë survenant dans les 3 mois suivant la greffe. Elle serait liée aux lymphocytes TH1 et serait plus fréquente lorsque le greffon
est d'origine médullaire
- la GVH chronique survenant après le 100ème jour serait plus fréquente avec les greffons de cellules souches issues du sang circulant. Elle serait
due aux lymphocytes TH2. Malgré les nombreux traitement existant, elle peut devenir à elle seule une vraie maladie.
- les infections bactériennes, fungiques, virales
Elles sont liées à l'immunodépression nécessaire à la greffe et peuvent constituer un cercle vicieux lors du traitement de la GVH.
Elles sont à l'origine de nombreux décès.
- la non prise hématopoïétique ou rejet secondaire
Elle survient plus souvent dans les greffes phénoidentiques ou les greffes de sang de cordon, plus rarement dans les greffes génoidentiques ou
phénoidentiques totalement matchés (10/10).
Dans les cas où existe un risque, un greffon autologue est prélevé avant la greffe si le donneur ne peut être reprélevé.
- les rechutes
Elles peuvent intervenir même lorsque les indications de greffe ont été bien posées en raison de facteurs de gravité de la pathologie en cause
(ex : certaines anomalies chromosomiques associées aux leucémies).
Elles surviennent plus fréquemment chez des patients n'ayant pas eu de réaction du greffon contre l'hôte et survenait très fréquemment lors de
greffes T déplétées (c'est-à-dire lorsque les lymphocytes T avaient été enlevés du greffon).
Le traitement du patient par des lymphocytes du donneur peut dans certains cas (en particulier dans la leucémie myéloïde chronique) entraîner une
disparition des cellules tumorales et une seconde rémission.
Les mécanismes de l'effet anti-leucémique des lymphocytes allogéniques restent à ce jour incomplètement élucidés, mais leurs résultats très prometteurs
ont entraîné beaucoup d'espoir dans les équipes de greffe.
Perspectives
Ils ont permis d'envisager d'étendre les indications des allogreffes aux tumeurs solides en particulier les cancers du sein et du rein et de ne plus restreindre ces traitements aux tumeurs hématopoiétiques (leucémies aigues, leucémies myéloides chroniques, lymphomes malins et myélomes)
Une meilleure connaissance des cibles antigéniques (antigènes mineurs d'histocompatibilité présents sur les cellules leucémiques et les cellules tissulaires normales de l'hôte ou bien d'antigènes spécifiques) et des effecteurs tissulaires (cellules T CD4+ ou CD8+, cellules NK) est indispensable pour pouvoir progresser.
Quoi qu'il en soit, les connaissances immunologiques autour de l'allogreffe , que ce soit une meilleure détermination des groupages HLA des donneurs et des receveurs par biologie moléculaire et une meilleure approche immunologique des greffons ont fait progresser ces techniques, repoussé les limites d'âge et étendu les indications. Les résultats en terme de survie et de qualité de vie des receveurs ont beaucoup progressé.
Les cinq années à venir devraient être riches en terme d'enseignement et d'amélioration de résultats dans l'intérêt des patients, des familles et des donneurs familiaux et non apparentés qui font un geste très fort en direction des gens qui souffrent.
 |
|
 |
 |
 |
|

